اتم هیدروژن - توجیه طیف اتم هیدروژن
رابطه ریدبرگ - بالمر
در فیزیک انتشار این امواج به این دلیل است که الکترونها در مدارهای مانا در اطراف هسته هیدروژن میگردند و هنگامی که از مدار مانا با انرژی بیشتر به مدار با انرژی کمتر بروند. نامگذاری هر انتقال به صورت بیان نام سری و سپس حروف الفبای یونانی است به این ترتیب که از نزدیکترین مدار اگر به مدار موردنظر رفت آلفا سپس بتا و دیگر حروف یونانی. توفیق بالمر در خصوص یافتن رابطهای برای خطهای طیف اتم هیدروژن در ناحیه مرئی موجب شد، که تلاشهای بیشتری در جهت یافتن خطوط دیگر طیف اتم هیدروژن صورت گیرد. بالمر که یک معلم سوئیسی بود، وی این اندازه گیریها را مطالعه کرد و نشان داد که طول موج خطهای این طیف را میتوان با دقت بسیار زیاد بدست آورد.

به افتخار یوهان بالمر نامگذاری شده و دوتای این خطوط در محدوده فرابنفش و بقیه آن در محدوده نور مرئی قرار میگیرد. همانطور که میدانیم نیوتون برای نخستین بار با گذراندن نور خورشید از منشور ، طیف نور سفید را تشکیل داد. میزان انرژی جذبشده یا تابششده میان الکترونی که در مدار مانا جابجا شود از فرمول ریدبرگ بدست میآید:. ⬅️قبل از عبور از منشور فقط نور صورتی کم رنگ است اما بعد از گذر از منشور ۴ خط رنگی تولید می کند. کار عمده در زمینه جستجو برای طیف کامل اتم هیدروژن توسط ریدبرگ در حدود سال 1850 میلادی انجام شد. آنگستروم تا سال 1885 میلادی طول موجهای چهار خط از طیف اتم هیدروژن را با دقت زیاد اندازه گرفت.

نیوتون نشان داد که نور سفید آمیزهای از رنگهای مختلف است و گسترده طول موجی این رنگها از 0. سریهای طیفی در اخترشناسی برای بررسی حضور هیدروژن و محاسبه انتقال قرمز کاربرد دارند. به نام فردریک براکت دانشمند آمریکایی که اولین بار در سال ۱۹۲۲ این خطوط را مشاهده کرد. مثلاً انتقال از ۲ → ۱ «لیمان-آلفا» (Ly-α) نامیده میشود و ۷ → ۳ «پاشن-دلتا» (Pa-δ). در طیف تابشی اتم هیدروژن چند سری وجود دارد که بر اساس فرمول ریدبرگ بدست میآید. به نام کاشف آن تئودور لیمان نامگذاری شدهاست و در محدوده فرابنفش قرار دارد. طیف اتمی هیدروژن ، اولین طیفی بود که بطور کامل مورد تجزیه و تحلیل قرار گرفت.

توجیه طیف نشری خطی هیدروژن
برای تولید طیف نشری خطی هیدروژن اگر در یک لوله تخلیه الکتریکی دارای فشار کم گاز هیدروژن، ولتاژی بالا اعمال کنیم در اثر التهاب گاز هیدروژن نوری به رنگ صورتی ایجاد می شود که در اثر عبور آن از یک منشور، طیف نشری خطی هیدروژن به وجود می آید. 2- هر انتقال طول موج و نور ویژه خود را دارد: n=6 ===>n=2 رنگ بنفش و طول موج 410 n=5 ===>n=2 رنگ آبی و طول موج 434 n=4 ===>n=2 رنگ سبز و طول موج 486 n=3===> n=2 رنگ قرمز و طول موج 656 برای بخاطر سپاری این 4طول موج کلمه (باسق) را بخاطر داشته باشید. (مثلا انتقال از 6 به 2 دارای مسیر بیشتری از بقیه بیشتر می باشد پس طول موج آن کمتر و انرژی بیشتری دارد) با این نکته حتی اگر رنگ طول موج را هم در سوال مشخص نشده باشد به نکات زیادی می توان پی برد.
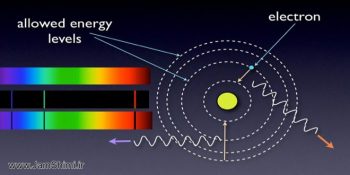
توجه: در اتم هیدروژن نقل و انتقال از سایر ترازها به ترازهای پایین تر نیز ممکن است و وجود داشته باشد اما فقط طول موج حاصل از این 4 انتقال در ناحیه مرئی بوده که در فیلم عکاسی ثبت می شود. 5- دقت کنید که بور با مدل اتمی خود طیف نشری خطی هیدروژن رو توجیه کرد اما چهار خط طیف نشری خطی هیدروژن رو نخستین بار آنگستروم پیدا کرد و 9 سال بعد طول موج هر خط را اندازه گیری کرد. 6- وقتی الکترون با گرفتن انرژی به تراز بینهایت منتقل می شود میگوییم یونش رخ داده است (تراز بینهایت نداریم در واقعا اگر از اتم الکترون برداریم تبدیل به یون + می شود). هر چه الکترون در تراز های بالاتر باشد یعنی انرژی بیشتری گرفته پس برای کندن آن نسبت به زمانی که در تراز های پایین تر باشد انرژی کمتری نیاز داریم.
بور اعتقاد داشت که 4 خط طیف نشری خطی هیدروژن به دلیل بازگشت الکترون های برانگیخته به حالت پایه و نشر نور توسط آنهاست. 3- فاصله ترازهای انرژی (لایه ها) در نزدیک هسته زیاد است به عبارتی اختلافات انرژی دو سطح در نزدیک هسته زیاد است. 4- الکترون هرچه مسیر بیشتری را طی کند (در حال برگشت) انرژی بیشتر و طول موج کمتری خواهد داشت. در ادامه از جم شیمی توجیه طیف نشری خطی هیدروژن را مورد بررسی قرار خواهیم داد. 1- نشر این 4 نور بدلیل بازگشت الکترون از تراز های 6_5_4_3 به تراز 2 است.
انیمیشن مربوط به طیف نشری خطی اتم هیدروژن
اگر در یک لوله تخلیه الکتریکی که دارای گاز هیدروژن است با فشار کم ، ولتاژ بالایی اعمال کنیم ، گاز درون لوله ملتهب (داغ ) شده و به رنگ صورتی روشن درآمده و باعبور دادن نور حاصل از منشور طیف نشری خطی هیدروژن بدست می آ ید. و دوباره به لایه های پایین تر (حالت پایه ) بر می گردد و مقدار انرژی که گرفته را آزاد می کند. ولی وقتی الکترون به لایه دوم n= 2 بر می گردد نور آن مریی است وقابل دیدن می باشد. **نکته : الکترون از لایه های بالاتر به همه لایه های پایین تر بر می گردد. الکترون هیدروژن در پایین ترین لایه الکترونی (حالت پایه ) قرار دارد. **نکته : الکترون در لایه های بالاتر (حالت برانگیخته) ناپایدار است.
که این انرژی های آزاد شده همان طیف نشری خطی هیدروژن می باشد.